Optische Mikroskopie jenseits der Beugungsgrenze: STED und verwandte Methoden
Ausgabe 25 | Oktober 2015 | „Mit der Auflösung jenseits der lichtmikroskopischen Beugungsgrenze ergeben sich viele neue Anwendungsgebiete. Oft bieten scheinbar verstandene Gebiete der Physik noch Raum für grundlegende Entdeckungen.“ Edward G. Krubasik, Präsident der Deutschen Physikalischen Gesellschaft Oktober 2015
Download: Physikkonkret 25 - Optische Mikroskopie jenseits der Beugungsgrenze: STED und verwandte Methoden

Der Nobelpreis für Chemie 2014 an drei Physiker würdigt das Überwinden der beugungsbedingten Auflösungsgrenze in der Fluoreszenzmikroskopie. Diese Grenze wurde im 19. Jahrhundert u. a. von Ernst Abbe beschrieben und galt lange Zeit für alle Lichtmikroskope, die herkömmliche Linsensysteme verwenden: Demnach lässt sich Licht nicht schärfer als bis auf die halbe Lichtwellenlänge – also minimal rund 200 Nanometer (nm; Millionstel Millimeter) – fokussieren. Alle Details, die enger beieinander liegen, erscheinen verschwommen.
Das STED-Verfahren (engl. Stimulated Emission Depletion) [1] überwand als erstes radikal diese Grenze. Obwohl es fokussiertes Licht verwendet, liefert es Auflösungen auf der Nanoskala [2 – 4], und somit bedeutsame Erkenntnisse in der Biomedizin [5].
Was ist nun fundamental anders? In herkömmlichen Mikroskopen erfolgt die Trennung benachbarter Strukturen durch das Bündeln von Licht (Abb. 1 oben). Je schärfer es fokussiert ist, desto feinere Strukturen lassen sich erkennen. Dem setzt die Beugung Grenzen. Alle fluoreszenzfähigen Moleküle, die innerhalb des Beugungsbereichs (grün) liegen, werden beleuchtet und de facto gleichzeitig zur Fluoreszenz angeregt. Ihre Signale überlagern sich am Detektor in der Bildebene. Die Moleküle innerhalb des Beugungsbereichs von minimal 200 nm lassen sich daher nicht ohne weiteres unterscheiden
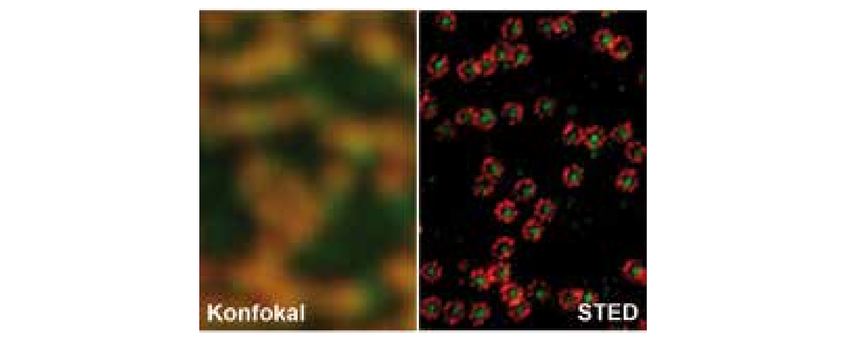
Der Schlüssel zur optischen Trennung liegt nun darin, einen Teil dieser Moleküle zeitweise in einen „dunklen“, nicht signalgebenden, Molekülzustand zu überführen. Misst man während dieses Zeitraums das Fluoreszenz-Signal, so lassen sich die hellen Moleküle von den dunklen unterscheiden. Im STED-Mikroskop erfolgt dieses Ausschalten der Moleküle ebenfalls durch Licht, und zwar mittels stimulierter Emission. Dabei wird ein angeregtes Molekül sofort in den dunklen Grundzustand überführt, damit es nicht fluoreszieren kann. Dazu verwendet man im Vergleich zur Anregung röteres Licht (Abb. 1 unten). Dieses ist räumlich mit einer Intensitätsnullstelle ausgebildet. Zudem ist die Intensität des Lichts so gewählt, dass Moleküle den fluoreszenten Zustand nur in einem engen Bereich um die Nullstelle annehmen können. Dieser Bereich ist deutlich kleiner als die Beugungsgrenze (d << 200 nm). Die anderen Moleküle befinden sich gezwungenermaßen im Grundzustand. Das macht die Moleküle unterscheidbar. Im Rasterverfahren werden nun Bilder der Probe erzeugt, die eine Auflösung von d besitzen (Abb. 2 und 3). Auflösungen bis hinunter zu 20 nm sind mittlerweile Routine; die prinzipielle Grenze ist allein durch die Größe der Moleküle gegeben.
Man kann auch mehrere Nullstellen gleichzeitig einsetzen, solange diese weiter entfernt sind als die Beugungsgrenze. Ferner lassen sich andere Dunkelzustände als der Grundzustand einsetzen, was das Verfahren genereller macht [2,3] (RESOLFT-Verfahren). Komplementäre Ansätze wie PALM [6] oder STORM [7] machen sich das gleiche An-/ Aus-Prinzip zur Trennung zunutze, schalten aber jeweils nur ein einzelnes Molekül innerhalb des Beugungsbereichs an.
Literatur
[1] Hell, S.W. & Wichmann J. Opt. Lett. 19, 780 (1994)
[2] Hell, S.W. & Kroug, M. Appl. Phys. B 60, 495 (1995)
[3] Hell, S.W. Nat. Biotechnol. 21, 1347 (2003)
[4] Hell, S. W. Physik Journal 6, Nr.12 (2007)
[5] Berning, S. et al. Science 335, 551 (2012)
[6] Betzig, E. et al. Science 313, 1642 (2006)
[7] Rust, M. et al. Nat. Methods 3, 793 (2006).
Weitere Informationen auf www.nanoscopy. de (Abb. 2 mit freundlicher Genehmigung von Abberior Instruments GmbH; Abb. 3 aus [5])
Die Deutsche Physikalische Gesellschaft dankt ihren Autoren Steffen J. Sahl und Stefan W. Hell Max-Planck-Institut für biophysikalische Chemie, Göttingen